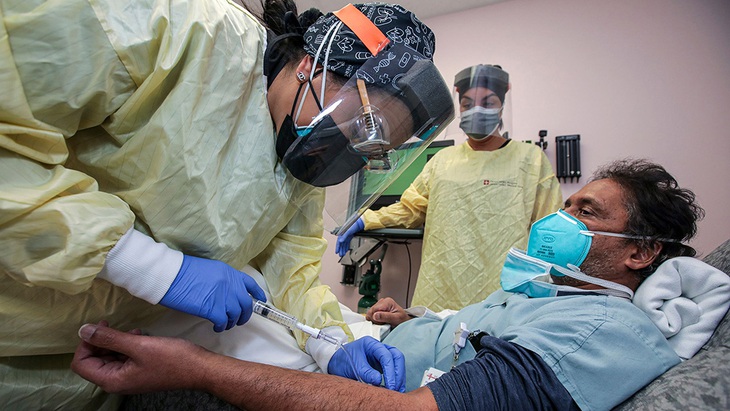
Bác sĩ Prabakar Tummala được tiêm kháng thể đơn dòng bamlanivimab tại Bệnh viện Desert Valley ở Victorville (Mỹ) vào tháng 12-2020 - Ảnh: SIPA
Từ ngày 15-3, Cơ quan An toàn thuốc và sản phẩm y tế quốc gia Pháp (ANSM) đã cho phép sử dụng tạm thời kháng thể đơn dòng để điều trị cho bệnh nhân người lớn có nguy cơ cao phát triển dạng COVID-19 nghiêm trọng như người bị suy giảm khả năng miễn dịch, người mắc bệnh có nguy cơ biến chứng hoặc người từ 70-80 tuổi mắc bệnh nền.
Kháng thể đơn dòng được sử dụng là hỗn hợp Casirivimab/Imdevimab của Hãng Roche (Thụy Sĩ) và Bamlanivimab/Etesevimab của Hãng Lilly France.
Báo cáo hằng tháng cho thấy dấu hiệu an toàn bảo đảm, nên ANSM quyết định mở rộng phạm vi sử dụng cho các đối tượng bệnh nhân khác.
Tính đến ngày 31-5 đã có hơn 1.000 bệnh nhân được điều trị bằng hỗn hợp kháng thể đơn dòng nêu trên.
Dữ liệu cảnh giác dược liên quan đến 50% số bệnh nhân này cho thấy chỉ xảy ra một số tác dụng phụ đã quan sát thấy trong thử nghiệm lâm sàng.
Do vậy, ANSM quyết định từ ngày 11-6 mở rộng phạm vi điều trị bằng kháng thể đơn dòng cho các đối tượng là trẻ em từ 12 tuổi trở lên có nguy cơ cao phát triển dạng COVID-19 nghiêm trọng, đặc biệt là ức chế miễn dịch nghiêm trọng; bệnh nhân người lớn mắc các bệnh mãn tính như béo phì, cao huyết áp phức tạp, đái tháo đường, suy thận, bệnh hô hấp mãn tính; bệnh nhân nhiễm HIV ở giai đoạn AIDS hoặc không kiểm soát được.
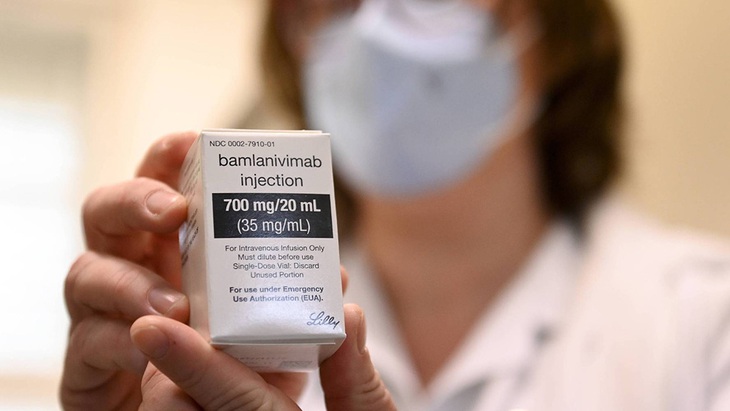
Thuốc tiêm kháng thể đơn dòng bamlanivimab - Ảnh: SIPA
Kháng thể đơn dòng được cơ thể sản xuất tự nhiên, nhưng cũng có thể được bào chế trong phòng thí nghiệm.
Thông thường cơ thể phải mất nhiều ngày mới sản sinh kháng thể đơn dòng. Tuy nhiên, theo liệu pháp điều trị bằng kháng thể đơn dòng, kháng thể được tiêm sớm hơn, tối đa 5 ngày sau khi xuất hiện các triệu chứng lâm sàng.
Kháng thể đơn dòng sẽ giữ vai trò làm tê liệt virus SARS-CoV-2 để ngăn virus lây nhiễm sang các tế bào khác.
Như vậy mục đích điều trị là giảm tác hại của bệnh, chứ không ngăn chặn được bệnh.
Hiện nay, sử dụng kháng thể đơn dòng trong điều trị bệnh nhân COVID-19 còn rất hạn chế vì liệu pháp này chưa được cấp phép rộng rãi.
Cơ quan Dược phẩm châu Âu đang tiến hành quy trình thẩm định thường xuyên để sẵn sàng cấp phép.










Tối đa: 1500 ký tự
Hiện chưa có bình luận nào, hãy là người đầu tiên bình luận